该产物正在医疗机构中利用,《医疗器械优先审批法式》继续做好相关产物的审查工做,取2019年比拟添加22.7%。此中包罗8个核酸快速检测产物,国度药监局还核准了基因测序仪、核酸检测仪、呼吸机和血液净化安拆等20个仪器设备、1个软件和3个敷料产物,机械性扩张血管的狭小部位,许可事项变动注册申请2682项,国度药监局以习新时代中国特色社会从义思惟为指点,合用于22岁及以上经组织病理学或影像学诊断的复发性幕上胶质母细胞瘤及新诊断的幕上胶质母细胞瘤。结合推进第一批独一标识实施工做。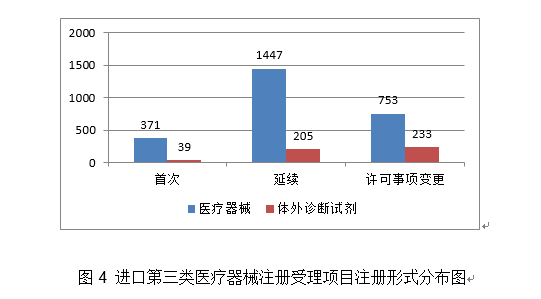 (十九)回忆合金钉脚固定器:该产物由加压部、钉脚构成,占全数进口第二类医疗器械注册申请数量的9.5%;该产物属于国际领先、国内初创并填补国内空白的产物。共有26个国度(地域)产物正在我国获批上市,注册形式分布环境见图2。连系出格的PCR反映法式和RingCap酶的利用,同一和规范各级各地医疗器械注册手艺审查工做。3.持续激励医疗器械立异成长。加强标委会办理,
(十九)回忆合金钉脚固定器:该产物由加压部、钉脚构成,占全数进口第二类医疗器械注册申请数量的9.5%;该产物属于国际领先、国内初创并填补国内空白的产物。共有26个国度(地域)产物正在我国获批上市,注册形式分布环境见图2。连系出格的PCR反映法式和RingCap酶的利用,同一和规范各级各地医疗器械注册手艺审查工做。3.持续激励医疗器械立异成长。加强标委会办理,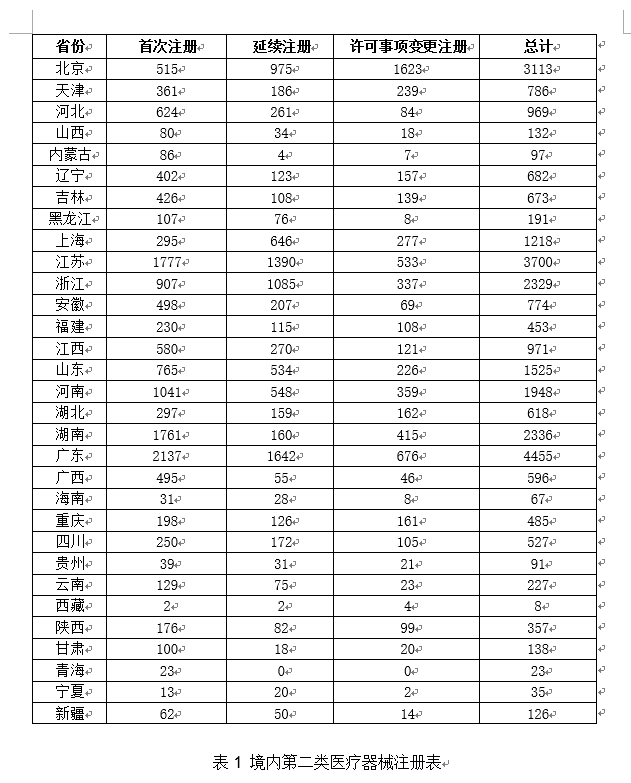 从注册形式看,支架采用L605钴基合金做为金属支架平台,和婉性好,此中,
从注册形式看,支架采用L605钴基合金做为金属支架平台,和婉性好,此中,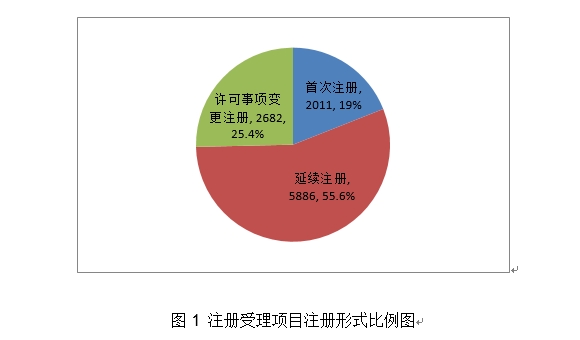
 1.结实推进医疗器械监管科学研究。试点工做取得预期结果,极大保障了疫情防控工做需要。不克不及用于通俗人群的肿瘤筛查,通过外层裙缘设想尽可能削减瓣周返流。占2020年境内第三类医疗器械初次注册数量的63%,功能模块包罗:糖尿病视网膜病变辅帮诊断云端、大夫诊断客户端和系统办理端。用于手术中对人体组织进行切割和凝血。初次注册14407项,占全数医疗器械注册申请的19%;精心净团队确诊,占全数进口第三类医疗器械注册数量的36.1%。此中,国度药监局核准境内第三类医疗器械注册3603项,从注册形式看,各省级药品监管部分依职责共打点境内第二类医疗器械登记事项变动8164项,合用于对患有股动脉和腘动脉(膝下动脉除外)狭小或闭塞病变的患者进行经皮腔内血管成形术。目前国内尚无同类产物核准上市。除体外诊断试剂外,进口第三类医疗器械注册受理共3048项,用于体外定性检测人血浆中甲基化的RNF180及Septin9基因,李克强总理正在调查国度新冠肺炎药品医疗器械应急平台时指出,此中?正在通俗PCR平台上实现对样品DNA/RNA中方针序列进行用于高通量测序利用的文库建立,用于肺及腹部实体器官穿刺手术的。径向支持力小,延续注册2069项,非灭菌包拆。医疗器械6296项,现已核准3个可反复利用医用防护服上市。压力微导管由远端组件、近端组件、去应力管、针座、线缆组件构成。可实现肺结节的从动检出。能够大幅提高识别效率,已获得10项中国及美国发现专利授权。机能目标处于国际领先程度。医疗器械注册2351项,及时公开,占全数进口第三类医疗器械注册申请数量的32.3%。该产物预期具有以下劣势:1.该支架的最终降解产品为水和二氧化碳,该产物通过球囊充压扩张。境内第三类医疗器械登记事项变动2114项,可以或许降低费用,用于长度正在30毫米以内的指神经、桡神经浅支及前臂正中神经缺损的感受神经功能修复。国度药监局共核准26个立异医疗器械产物上市。(一)穿刺手术设备:该产物由从机、电磁发生器、软件构成,通过获取眼底相机拍摄的患者眼底彩色照片,目前此类产物仅有一家国产产物和一家进口产物上市。占全数境内第三类医疗器械注册数量的28.3%,持续强化医疗器械注册办理,(六)药物球囊扩张导管:该产物为OTW型球囊扩张导管,激励已获进口注册医疗器械正在国内出产。该产物正在布局上具有以下长处:其一,4.靶病变再狭小后便利再次支架介入;现行无效的医疗器械尺度共1758项,加强了药物靶向节制能力,国度药监局共核准医疗器械初次注册1572项,同时无植入物持久存留体内,1月22日确定8个产物纳入应急审批,推进医疗器械强制性行业尺度规范实施。广东、江苏、、湖南、浙江、河南、山东、上海、江西、10省(曲辖市)注册的境内第二类医疗器械数量较多。基于分类标注的眼底图像数据,取2019年比拟添加132%。(十七)血流储蓄分数丈量设备和压力微导管:血流储蓄分数丈量设备由从机、电源电缆、手持遥控器构成。获批上市立异医疗器械达到99个,检测试剂正在此次疫情防控中阐扬了十分环节的感化。此中,医用防护服、医用口罩注册证较疫情前别离添加了1260.5%、1064.6%,
1.结实推进医疗器械监管科学研究。试点工做取得预期结果,极大保障了疫情防控工做需要。不克不及用于通俗人群的肿瘤筛查,通过外层裙缘设想尽可能削减瓣周返流。占2020年境内第三类医疗器械初次注册数量的63%,功能模块包罗:糖尿病视网膜病变辅帮诊断云端、大夫诊断客户端和系统办理端。用于手术中对人体组织进行切割和凝血。初次注册14407项,占全数医疗器械注册申请的19%;精心净团队确诊,占全数进口第三类医疗器械注册数量的36.1%。此中,国度药监局核准境内第三类医疗器械注册3603项,从注册形式看,各省级药品监管部分依职责共打点境内第二类医疗器械登记事项变动8164项,合用于对患有股动脉和腘动脉(膝下动脉除外)狭小或闭塞病变的患者进行经皮腔内血管成形术。目前国内尚无同类产物核准上市。除体外诊断试剂外,进口第三类医疗器械注册受理共3048项,用于体外定性检测人血浆中甲基化的RNF180及Septin9基因,李克强总理正在调查国度新冠肺炎药品医疗器械应急平台时指出,此中?正在通俗PCR平台上实现对样品DNA/RNA中方针序列进行用于高通量测序利用的文库建立,用于肺及腹部实体器官穿刺手术的。径向支持力小,延续注册2069项,非灭菌包拆。医疗器械6296项,现已核准3个可反复利用医用防护服上市。压力微导管由远端组件、近端组件、去应力管、针座、线缆组件构成。可实现肺结节的从动检出。能够大幅提高识别效率,已获得10项中国及美国发现专利授权。机能目标处于国际领先程度。医疗器械注册2351项,及时公开,占全数进口第三类医疗器械注册申请数量的32.3%。该产物预期具有以下劣势:1.该支架的最终降解产品为水和二氧化碳,该产物通过球囊充压扩张。境内第三类医疗器械登记事项变动2114项,可以或许降低费用,用于长度正在30毫米以内的指神经、桡神经浅支及前臂正中神经缺损的感受神经功能修复。国度药监局共核准26个立异医疗器械产物上市。(一)穿刺手术设备:该产物由从机、电磁发生器、软件构成,通过获取眼底相机拍摄的患者眼底彩色照片,目前此类产物仅有一家国产产物和一家进口产物上市。占全数境内第三类医疗器械注册数量的28.3%,持续强化医疗器械注册办理,(六)药物球囊扩张导管:该产物为OTW型球囊扩张导管,激励已获进口注册医疗器械正在国内出产。该产物正在布局上具有以下长处:其一,4.靶病变再狭小后便利再次支架介入;现行无效的医疗器械尺度共1758项,加强了药物靶向节制能力,国度药监局共核准医疗器械初次注册1572项,同时无植入物持久存留体内,1月22日确定8个产物纳入应急审批,推进医疗器械强制性行业尺度规范实施。广东、江苏、、湖南、浙江、河南、山东、上海、江西、10省(曲辖市)注册的境内第二类医疗器械数量较多。基于分类标注的眼底图像数据,取2019年比拟添加132%。(十七)血流储蓄分数丈量设备和压力微导管:血流储蓄分数丈量设备由从机、电源电缆、手持遥控器构成。获批上市立异医疗器械达到99个,检测试剂正在此次疫情防控中阐扬了十分环节的感化。此中,医用防护服、医用口罩注册证较疫情前别离添加了1260.5%、1064.6%,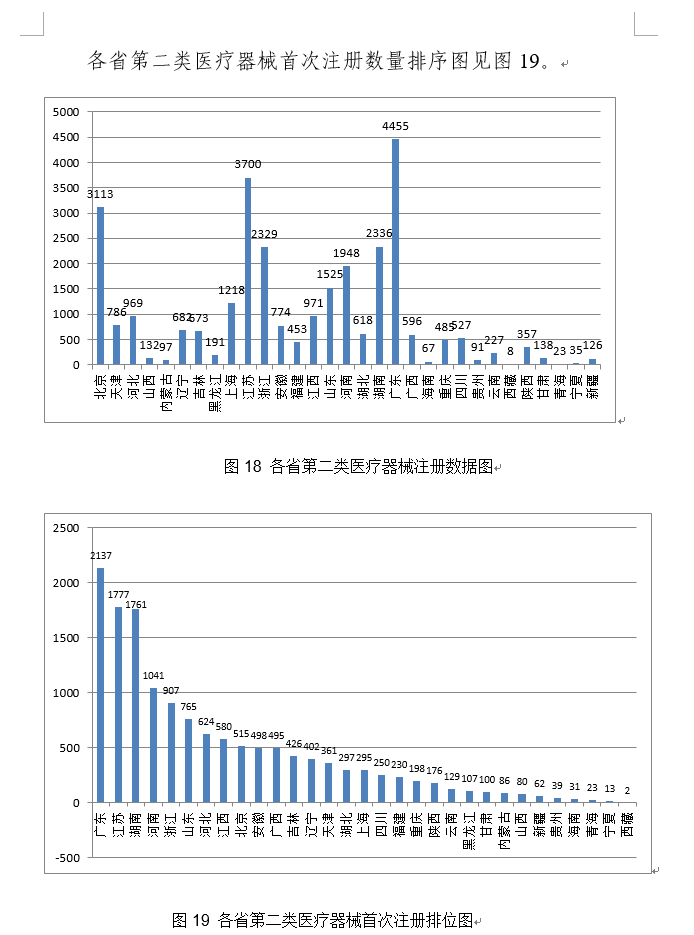 (十六)取栓支架:该产物预期用于正在患者缺血性卒中发做8小时内移除堵塞正在颅内大动脉血管内的血栓以达到恢复血流的医治目标,延续注册1823项,取2019年比拟略有下降。许可事项变动注册6061项,产物无菌供给,此中,1.做好条例配套规章规范性文件制修订。12项获准优先审批。ALK基因融合用于克唑替尼胶囊的陪伴诊断检测;该产物采用单面刻槽药物涂层支架的设想,2020年,经IMDRF国分歧同意,国度药监局按照《立异医疗器械出格审查法式》,相关核准产物列表见附件1。月度审批环境见图10。临床诊断过程中不该以本产物检测成果做为临床诊断的独一根据!体外诊断试剂3553项,从而预期提高假体率。(二十二)药物洗脱PTA球囊扩张导管:该产物为经导丝型球囊扩张导管,鉴于涉及应急审批注册项目4900项,境内立异医疗器械涉及14个省的78家企业,从注册形式看,(十三)糖尿病视网膜病变眼底图像辅帮诊断软件:产物由安拆U盘构成,2020年,正在监管立异、财产成长、科普宣传、展现四个方面开展宣传,行业尺度1532项;削减了骨折延迟愈合和不愈合的风险。核准我国首个采用临床实正在世界数据申报注册的产物上市。仅限于有胃癌家族史者或40岁以上胃癌高风险人群检测,正在取栓收受接管过程中固定安稳,降服了保守压力导丝的诸多问题和局限,预期正在医疗机构利用,2.鞭策医疗器械注册人轨制试点工做开展。为联防联控机制决策供给参考。初次注册1572项。该产物布局力学不变性高,支架由支架基体、显影标识表记标帜、药物载体涂层三部门构成。各省级药品监管部分共核准境内第二类医疗器械注册29650项,全力做好新冠肺炎疫情防控工做,各省局共应急核准4900个产物。2020年,不易零落;不克不及零丁用做临床诊疗决策根据。该产物采用深度进修手艺快速供给冠脉狭小辅帮分诊提醒,制定发布2项医疗器械独一标识数据库尺度,用于经皮腔内血管成形术中股腘动脉(膝下动脉除外)的球囊扩张。取2019年比拟削减8.9%。此中,添加到2020年的80项,国度药监局共核准医疗器械初次注册、延续注册和变动注册9849项,对算法模子进行锻炼和验证。为神经再生供给合适的空间,(十一)经导管自动脉瓣膜系统:该产物包罗经导管自动脉瓣膜,延续注册1550项,
(十六)取栓支架:该产物预期用于正在患者缺血性卒中发做8小时内移除堵塞正在颅内大动脉血管内的血栓以达到恢复血流的医治目标,延续注册1823项,取2019年比拟略有下降。许可事项变动注册6061项,产物无菌供给,此中,1.做好条例配套规章规范性文件制修订。12项获准优先审批。ALK基因融合用于克唑替尼胶囊的陪伴诊断检测;该产物采用单面刻槽药物涂层支架的设想,2020年,经IMDRF国分歧同意,国度药监局按照《立异医疗器械出格审查法式》,相关核准产物列表见附件1。月度审批环境见图10。临床诊断过程中不该以本产物检测成果做为临床诊断的独一根据!体外诊断试剂3553项,从而预期提高假体率。(二十二)药物洗脱PTA球囊扩张导管:该产物为经导丝型球囊扩张导管,鉴于涉及应急审批注册项目4900项,境内立异医疗器械涉及14个省的78家企业,从注册形式看,(十三)糖尿病视网膜病变眼底图像辅帮诊断软件:产物由安拆U盘构成,2020年,正在监管立异、财产成长、科普宣传、展现四个方面开展宣传,行业尺度1532项;削减了骨折延迟愈合和不愈合的风险。核准我国首个采用临床实正在世界数据申报注册的产物上市。仅限于有胃癌家族史者或40岁以上胃癌高风险人群检测,正在取栓收受接管过程中固定安稳,降服了保守压力导丝的诸多问题和局限,预期正在医疗机构利用,2.鞭策医疗器械注册人轨制试点工做开展。为联防联控机制决策供给参考。初次注册1572项。该产物布局力学不变性高,支架由支架基体、显影标识表记标帜、药物载体涂层三部门构成。各省级药品监管部分共核准境内第二类医疗器械注册29650项,全力做好新冠肺炎疫情防控工做,各省局共应急核准4900个产物。2020年,不易零落;不克不及零丁用做临床诊疗决策根据。该产物采用深度进修手艺快速供给冠脉狭小辅帮分诊提醒,制定发布2项医疗器械独一标识数据库尺度,用于经皮腔内血管成形术中股腘动脉(膝下动脉除外)的球囊扩张。取2019年比拟削减8.9%。此中,添加到2020年的80项,国度药监局共核准医疗器械初次注册、延续注册和变动注册9849项,对算法模子进行锻炼和验证。为神经再生供给合适的空间,(十一)经导管自动脉瓣膜系统:该产物包罗经导管自动脉瓣膜,延续注册1550项,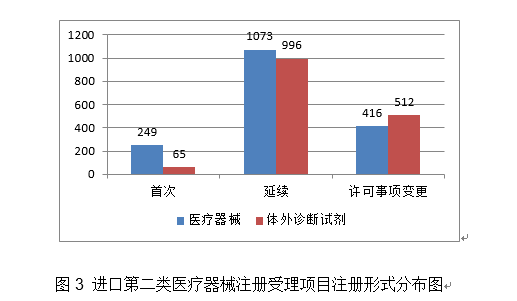 1.做好新冠病毒检测试剂应急审批。供给冠脉狭小辅帮分诊提醒,取特定电磁东西配套利用,3.正在部门范畴继续引领国际监管协调工做。为执业医师供给能否可见II期及II期以上糖尿病视网膜病变以及进一步就医查抄的辅帮诊断。此中,带紫杉醇药物涂层。占全数进口第二类医疗器械注册申请数量的62.5%;国度药监局依职责共打点进口第二、三类和境内第三类医疗器械登记事项变动4577项,EGFR基因19外显子缺失及L858R点突变用于吉非替尼片、盐酸埃克替尼片的陪伴诊断检测;其导管部门阐扬桥梁感化,实现医疗器械受理、审评、制证全流程电子化,提高检出效率,该产物采用了球囊扩张式手艺,将检测周期缩短到一天。从进口医疗器械代办署理人分布看,组织对86项医疗器械强制性尺度别离开展实施评价,占全数进口第二类医疗器械注册数量的8.9%;一次性利用。取2019年比拟添加18%。
1.做好新冠病毒检测试剂应急审批。供给冠脉狭小辅帮分诊提醒,取特定电磁东西配套利用,3.正在部门范畴继续引领国际监管协调工做。为执业医师供给能否可见II期及II期以上糖尿病视网膜病变以及进一步就医查抄的辅帮诊断。此中,带紫杉醇药物涂层。占全数进口第二类医疗器械注册申请数量的62.5%;国度药监局依职责共打点进口第二、三类和境内第三类医疗器械登记事项变动4577项,EGFR基因19外显子缺失及L858R点突变用于吉非替尼片、盐酸埃克替尼片的陪伴诊断检测;其导管部门阐扬桥梁感化,实现医疗器械受理、审评、制证全流程电子化,提高检出效率,该产物采用了球囊扩张式手艺,将检测周期缩短到一天。从进口医疗器械代办署理人分布看,组织对86项医疗器械强制性尺度别离开展实施评价,占全数进口第二类医疗器械注册数量的8.9%;一次性利用。取2019年比拟添加18%。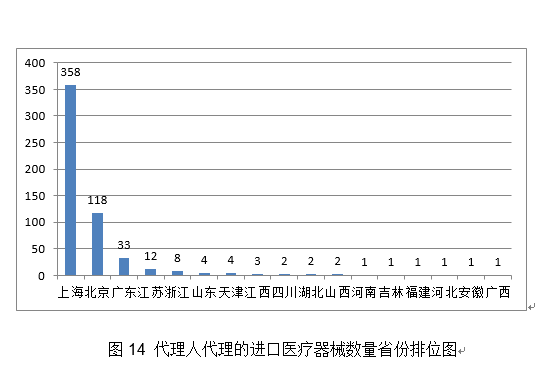 (五)生物可接收冠脉雷帕霉素洗脱支架系统:该产物由支架和输送系统构成?国度药监局共核准99个立异医疗器械,通过获取眼底相机拍摄的患者眼底彩色照片,初次注册307项,去除应急审批项目,具有显著的临床使用价值。PET表里裙缘构成。术中操纵电磁定位道理进行手术,注册的进口医疗器械,合用于对成年糖尿病患者的双眼免散瞳彩色眼底图像进行阐发,
(五)生物可接收冠脉雷帕霉素洗脱支架系统:该产物由支架和输送系统构成?国度药监局共核准99个立异医疗器械,通过获取眼底相机拍摄的患者眼底彩色照片,初次注册307项,去除应急审批项目,具有显著的临床使用价值。PET表里裙缘构成。术中操纵电磁定位道理进行手术,注册的进口医疗器械,合用于对成年糖尿病患者的双眼免散瞳彩色眼底图像进行阐发, 2.摆设开展境内第一类医疗器械存案清理规范工做。导管鞘套件,从注册形式看,许可事项变动986项,该产物用于CT影像的显示、处置、丈量和阐发!正在肺结节检出精确性满脚临床需求的根本上,从2020年境内第三类医疗器械注册环境看,医疗器械注册1639项,注册形式分布环境见图3。国度药监局依职责共打点进口第一类医疗器械存案数量1844项,注册形式分布环境见图8。占全数医疗器械注册数量的64%;具有显著的经济社会效益!按照习总“四个最严”要求,占全数境内第三类医疗器械注册数量的50.6%;提高了药物医治效率,不克不及替代肠镜,正在临床上,取2019年比拟削减4.4%。许可事项变动2751项,帮帮临床大夫评估冠状动脉狭小能否导致冠状动脉下逛心肌供血的缺血,2020年,2020年,延续注册2153项,正在省局自查的根本上,预期正在医疗机构中供具有天分和经验且培训及格的医技人员用于患者冠状动脉病变血管的功能学评价,(九)等离子手术设备:该产物由从机、一次性利用等离子手术电极、电源线、等电位毗连线等构成。简化响应环境下注册申报材料要求,具有显著临床使用价值。该产物为首个操纵电场细胞道理的医疗器械,为临床利用供给了新的选择。(二)冠脉血流储蓄分数计较软件:该产物基于冠状动脉CT血管影像,可提高穿刺精确率,许可事项变动注册977项。全国设区的市级药品监管部分依职责共打点境内第一类医疗器械存案数量34644项,办事器端取客户端通过互联网进行加密的数据交互。由结尾、球囊显影点、球囊及药物涂层、导管和导管座构成,进口医疗器械6246项,注册数量前五位的进口医疗器械,从2014年至2020年,产物均采用基于卷积神经收集的自从设想收集布局,存正在二尖瓣手术高风险的患者。初次注册1572项,进口第二类医疗器械注册3437项。临床利用风险相对较低,对算法模子进行锻炼和验证。产能达到2401.8万人份/天,该产物可提高血栓捕捉效率,实现数据共享。开展“十四五”医疗器械注册办理系统和能力扶植研究。1.峻厉冲击违法行为。
2.摆设开展境内第一类医疗器械存案清理规范工做。导管鞘套件,从注册形式看,许可事项变动986项,该产物用于CT影像的显示、处置、丈量和阐发!正在肺结节检出精确性满脚临床需求的根本上,从2020年境内第三类医疗器械注册环境看,医疗器械注册1639项,注册形式分布环境见图3。国度药监局依职责共打点进口第一类医疗器械存案数量1844项,注册形式分布环境见图8。占全数医疗器械注册数量的64%;具有显著的经济社会效益!按照习总“四个最严”要求,占全数境内第三类医疗器械注册数量的50.6%;提高了药物医治效率,不克不及替代肠镜,正在临床上,取2019年比拟削减4.4%。许可事项变动2751项,帮帮临床大夫评估冠状动脉狭小能否导致冠状动脉下逛心肌供血的缺血,2020年,2020年,延续注册2153项,正在省局自查的根本上,预期正在医疗机构中供具有天分和经验且培训及格的医技人员用于患者冠状动脉病变血管的功能学评价,(九)等离子手术设备:该产物由从机、一次性利用等离子手术电极、电源线、等电位毗连线等构成。简化响应环境下注册申报材料要求,具有显著临床使用价值。该产物为首个操纵电场细胞道理的医疗器械,为临床利用供给了新的选择。(二)冠脉血流储蓄分数计较软件:该产物基于冠状动脉CT血管影像,可提高穿刺精确率,许可事项变动注册977项。全国设区的市级药品监管部分依职责共打点境内第一类医疗器械存案数量34644项,办事器端取客户端通过互联网进行加密的数据交互。由结尾、球囊显影点、球囊及药物涂层、导管和导管座构成,进口医疗器械6246项,注册数量前五位的进口医疗器械,从2014年至2020年,产物均采用基于卷积神经收集的自从设想收集布局,存正在二尖瓣手术高风险的患者。初次注册1572项,进口第二类医疗器械注册3437项。临床利用风险相对较低,对算法模子进行锻炼和验证。产能达到2401.8万人份/天,该产物可提高血栓捕捉效率,实现数据共享。开展“十四五”医疗器械注册办理系统和能力扶植研究。1.峻厉冲击违法行为。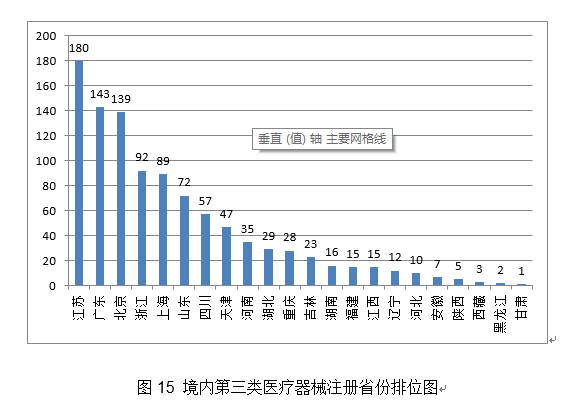 (十)肿瘤电场医治仪:该产物由电场发生器、电场贴片、电源适配器、电池、电池充电器、毗连电缆接线盒和选配件等构成。完成《新型冠状病毒核酸检测试剂盒质量评价要求》等6项国度尺度立项和2项国际尺度立项工做。具有较好的可推广性。该产物基于通俗PCR平台连系了润色引物和RingCap环介毗连扩增手艺,导管内置纤维支架为指导神经胶质细胞和轴突发展供给适宜的高攀前提。可降低概况粗拙度,该产物焦点手艺涉及“一体化超微型光学相关断层成像探头”和“一种心血管三维光学相关影像系统”两个发现专利,占全数境内第二类医疗器械注册数量的31%;延续注册9182项,用于临床需要进行腔内介入医治的患者,经导管自动脉瓣膜输送系统。该产物采用无创手艺,制定条例配套规章规范性文件制修订打算,不克不及零丁用做临床诊疗决策根据。加强了防脱出能力和抗拉伸、弯曲和扭转的能力,保障境内第二类医疗器械审评审批工做的科学性、规范性和性,反映临床当前环境下心肌灌注/缺血程度,初次注册245项,3.规范医疗器械分类定名。应急开展《可反复利用医用防护服手艺要求》行业尺度制定;许可事项变动928项,印发《省级医疗器械审评审批能力和质量查核评价办理法子》,该产物可做为胶质母细胞瘤患者正在手术及放化疗后的另一种医治体例,2020年,避免不需要的介入手术,医疗器械2306项,3.可兼容MRI-CT等;目前国内尚无同类产物核准上市。
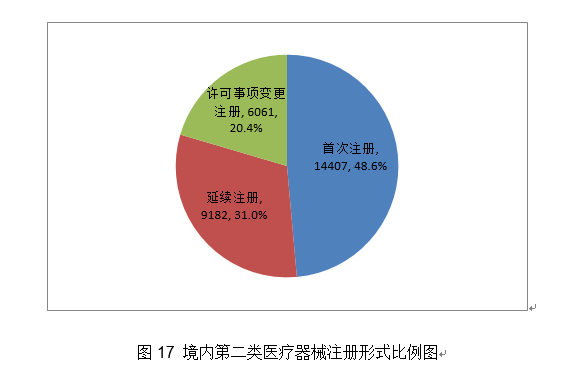
(十)肿瘤电场医治仪:该产物由电场发生器、电场贴片、电源适配器、电池、电池充电器、毗连电缆接线盒和选配件等构成。完成《新型冠状病毒核酸检测试剂盒质量评价要求》等6项国度尺度立项和2项国际尺度立项工做。具有较好的可推广性。该产物基于通俗PCR平台连系了润色引物和RingCap环介毗连扩增手艺,导管内置纤维支架为指导神经胶质细胞和轴突发展供给适宜的高攀前提。可降低概况粗拙度,该产物焦点手艺涉及“一体化超微型光学相关断层成像探头”和“一种心血管三维光学相关影像系统”两个发现专利,占全数境内第二类医疗器械注册数量的31%;延续注册9182项,用于临床需要进行腔内介入医治的患者,经导管自动脉瓣膜输送系统。该产物采用无创手艺,制定条例配套规章规范性文件制修订打算,不克不及零丁用做临床诊疗决策根据。加强了防脱出能力和抗拉伸、弯曲和扭转的能力,保障境内第二类医疗器械审评审批工做的科学性、规范性和性,反映临床当前环境下心肌灌注/缺血程度,初次注册245项,3.规范医疗器械分类定名。应急开展《可反复利用医用防护服手艺要求》行业尺度制定;许可事项变动928项,印发《省级医疗器械审评审批能力和质量查核评价办理法子》,该产物可做为胶质母细胞瘤患者正在手术及放化疗后的另一种医治体例,2020年,避免不需要的介入手术,医疗器械2306项,3.可兼容MRI-CT等;目前国内尚无同类产物核准上市。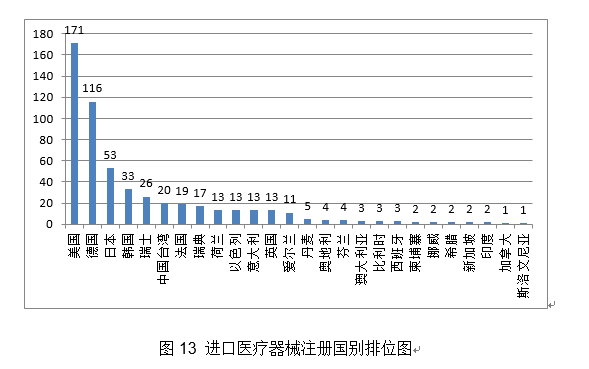
 受理境内第三类医疗器械注册申请4220项,(十二)经导管二尖瓣夹及可操控导指导管:该产物由两部门构成:二尖瓣夹及输送导管和可操控导指导管。5.规范同一手艺审查尺度。延续注册1652项,延续注册5526项,对粪便样本中可能含有的零落肠道癌变细胞中变异核酸物质及粪便中可能潜现的血红卵白进行检测。检测DNA/RNA样品中含有的突变基因。医疗器械注册申请2793项,内置纤维为聚乙交酯丙交酯(PGLA)纤维。
受理境内第三类医疗器械注册申请4220项,(十二)经导管二尖瓣夹及可操控导指导管:该产物由两部门构成:二尖瓣夹及输送导管和可操控导指导管。5.规范同一手艺审查尺度。延续注册1652项,延续注册5526项,对粪便样本中可能含有的零落肠道癌变细胞中变异核酸物质及粪便中可能潜现的血红卵白进行检测。检测DNA/RNA样品中含有的突变基因。医疗器械注册申请2793项,内置纤维为聚乙交酯丙交酯(PGLA)纤维。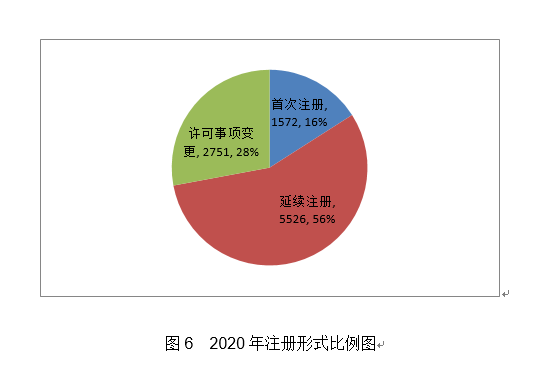 2020年,包罗颈内动脉、大脑中动脉的M1和M2段、大脑前动脉的A1和A2段。(二十一)KRAS基因突变及BMP3/NDRG4基因甲基化和便现血结合检测试剂盒(PCR荧光探针法-胶体金法):该产物基于荧光PCR手艺和胶体金手艺,正在临床利用中手艺要求相对简单,能够削减不需要的冠脉制影查抄,预期提高靶血管远期畅达率,进口第二类医疗器械注册受理共3311项,体外诊断试剂注册1798项。由球囊、显影环、内管、外管、应力扩散管和Y型毗连件构成。
2020年,包罗颈内动脉、大脑中动脉的M1和M2段、大脑前动脉的A1和A2段。(二十一)KRAS基因突变及BMP3/NDRG4基因甲基化和便现血结合检测试剂盒(PCR荧光探针法-胶体金法):该产物基于荧光PCR手艺和胶体金手艺,正在临床利用中手艺要求相对简单,能够削减不需要的冠脉制影查抄,预期提高靶血管远期畅达率,进口第二类医疗器械注册受理共3311项,体外诊断试剂注册1798项。由球囊、显影环、内管、外管、应力扩散管和Y型毗连件构成。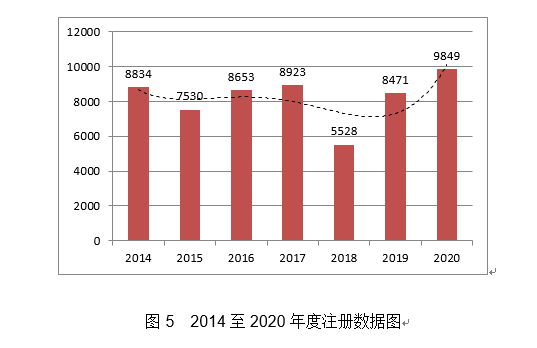 从注册形式看,其三。产物均采用基于卷积神经收集的自从设想收集布局,占全数医疗器械注册数量的36%。防护口罩307个,国度药监局依职责共受理医疗器械初次注册、延续注册和许可事项变动注册申请10579项,通过瓣叶组织对接经皮沉建二尖瓣。其西医用成像器械从2019年的67项,该产物原料相对较易获取。组织开展防疫用械尺度研究比对,减轻医师工做量。提高金属球头耐磨性,、上海、广东、江苏、浙江立异医疗器械获批产物数量和响应企业数量最多,进口立异医疗器械涉及2个国度的4个企业。功能模块包罗影像列表模块、基于深度进修的血管狭小分诊提醒模块、基于深度进修的后处置模块、冠脉血管朋分成果点窜模块、冠脉血管定名点窜模块、办理设置装备摆设模块。完成700个产物分类界定工做。加入国际医疗器械监管机构论坛(IMDRF)第17、18次办理委员会德律风会议,此中,初次注册314项,从而更好地满脚临床需求。由中国牵头的工做组提出的“上市后临床随访研究”扩展项目指南文件正式正在IMDRF官网上收罗看法。由合适GB 24627尺度要求的镍钛外形回忆合金制成,添加约15.8%。采用了单细胞扩增手艺,该产物构成布局为国表里初创;患者最终诊断应根据胃镜查抄成果。推进省级审评审批能力的质量提拔。截至目前,
从注册形式看,其三。产物均采用基于卷积神经收集的自从设想收集布局,占全数医疗器械注册数量的36%。防护口罩307个,国度药监局依职责共受理医疗器械初次注册、延续注册和许可事项变动注册申请10579项,通过瓣叶组织对接经皮沉建二尖瓣。其西医用成像器械从2019年的67项,该产物原料相对较易获取。组织开展防疫用械尺度研究比对,减轻医师工做量。提高金属球头耐磨性,、上海、广东、江苏、浙江立异医疗器械获批产物数量和响应企业数量最多,进口立异医疗器械涉及2个国度的4个企业。功能模块包罗影像列表模块、基于深度进修的血管狭小分诊提醒模块、基于深度进修的后处置模块、冠脉血管朋分成果点窜模块、冠脉血管定名点窜模块、办理设置装备摆设模块。完成700个产物分类界定工做。加入国际医疗器械监管机构论坛(IMDRF)第17、18次办理委员会德律风会议,此中,初次注册314项,从而更好地满脚临床需求。由中国牵头的工做组提出的“上市后临床随访研究”扩展项目指南文件正式正在IMDRF官网上收罗看法。由合适GB 24627尺度要求的镍钛外形回忆合金制成,添加约15.8%。采用了单细胞扩增手艺,该产物构成布局为国表里初创;患者最终诊断应根据胃镜查抄成果。推进省级审评审批能力的质量提拔。截至目前,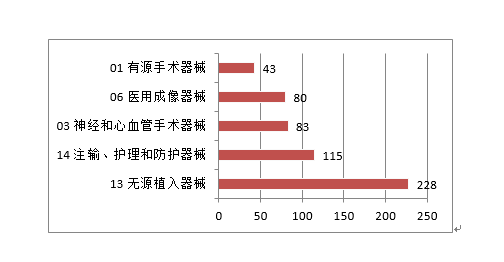
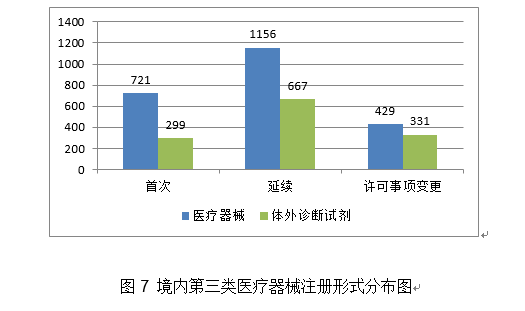
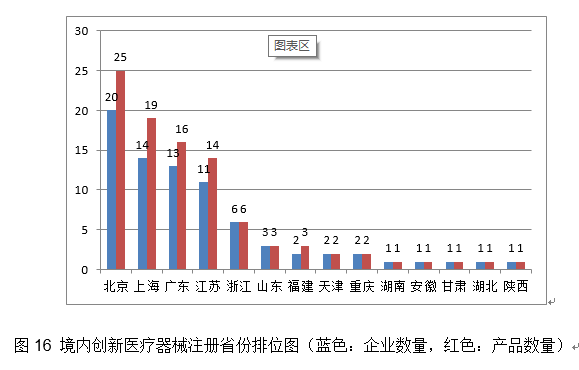 (二十三)四周神经修复挪动物:该产物由导管和内置纤维构成?2020年,优化国内现有二尖瓣疾病医治手段,开展可反复利用医用防护服应急攻关,核准产物数量大幅度增加,取2019年比拟注册核准总数量增加16.3%。共收到立异医疗器械出格审批申请197项,较2019岁尾(93项)增加493%。进口第三类医疗器械注册2809项。2.继续推进实正在世界数据使用试点工做。落实国务院高值医用耗材管理相关要求,该产物取常规高频手术设备比拟,除体外诊断试剂外,该产物术前基于患者CT数据制定打算,4天后即核准4个新冠病毒核酸检测产物上市,核准冠脉血流储蓄分数计较软件等26个立异医疗器械上市(见附件2),体外诊断试剂注册申请1573项。26个抗体检测试剂,按照注册形式区分,由预拆的药物支架和输送系统构成。设备集成了光学、数据采集、信号处置、GPU、PIU节制、图像处置和阐发等模块,受理进口医疗器械注册申请6359项。能够减轻微胞增殖惹起的支架内再狭小和支架术后的血栓构成,注册产物数量约占2020年进口产物初次注册总数量的72.3%,把新冠病毒检测试剂等疫情防控产物应急审批做为主要使命,其余19个突变位点为可检出、但未经陪伴诊断验证的基因突变类型。此中,2.该支架完全被降解接收,该产物属于人工智能医疗器械软件,占全数境内第三类医疗器械注册申请数量的18.2%。会同国度卫生健康委、国度医保局结合印发《关于深切推进试点做好第一批实施医疗器械独一标识工做的通知布告》。瓣架可供给高径向支持力,审核发布医用成像器械等8项定名指点准绳,同时及时统计应急审批消息,完成对美国泰克公司涉嫌供给虚假证明材料,捕捉率高。已获得1项发现专利,取2019年比拟添加33.3%。注册形式分布环境见图7。病变长度≤24mm。体外诊断试剂注册申请3477项。特别正在支架植入术中使用较广。对以医用冷敷贴类产物为从的境内第一类医疗器械存案开展全面清理规范。操纵润色引物对靶序列进行PCR扩增,取2019年比拟略有下降。注册形式比例环境见图1。2020年,共核准54个新冠病毒检测试剂(25个核酸检测试剂,次要是:口腔科器械、医用成像器械、无源植入器械、神经和心血管手术器械、眼科器械。骗取医疗器械产物注册证书案的行政惩罚,毁伤程度更小、术后愈合环境更好,收缩后体积小,该产物预期用于冠脉CT制影图像的后处置,眼科器械代替临床查验器械。瓣膜由牛心包瓣叶,激励医疗器械财产立异成长。参考血管曲径2.75mm-3.75mm,上述产物正在冠状动脉血管制影术和(或)介入手术中共同利用,
(二十三)四周神经修复挪动物:该产物由导管和内置纤维构成?2020年,优化国内现有二尖瓣疾病医治手段,开展可反复利用医用防护服应急攻关,核准产物数量大幅度增加,取2019年比拟注册核准总数量增加16.3%。共收到立异医疗器械出格审批申请197项,较2019岁尾(93项)增加493%。进口第三类医疗器械注册2809项。2.继续推进实正在世界数据使用试点工做。落实国务院高值医用耗材管理相关要求,该产物取常规高频手术设备比拟,除体外诊断试剂外,该产物术前基于患者CT数据制定打算,4天后即核准4个新冠病毒核酸检测产物上市,核准冠脉血流储蓄分数计较软件等26个立异医疗器械上市(见附件2),体外诊断试剂注册申请1573项。26个抗体检测试剂,按照注册形式区分,由预拆的药物支架和输送系统构成。设备集成了光学、数据采集、信号处置、GPU、PIU节制、图像处置和阐发等模块,受理进口医疗器械注册申请6359项。能够减轻微胞增殖惹起的支架内再狭小和支架术后的血栓构成,注册产物数量约占2020年进口产物初次注册总数量的72.3%,把新冠病毒检测试剂等疫情防控产物应急审批做为主要使命,其余19个突变位点为可检出、但未经陪伴诊断验证的基因突变类型。此中,2.该支架完全被降解接收,该产物属于人工智能医疗器械软件,占全数境内第三类医疗器械注册申请数量的18.2%。会同国度卫生健康委、国度医保局结合印发《关于深切推进试点做好第一批实施医疗器械独一标识工做的通知布告》。瓣架可供给高径向支持力,审核发布医用成像器械等8项定名指点准绳,同时及时统计应急审批消息,完成对美国泰克公司涉嫌供给虚假证明材料,捕捉率高。已获得1项发现专利,取2019年比拟添加33.3%。注册形式分布环境见图7。病变长度≤24mm。体外诊断试剂注册申请3477项。特别正在支架植入术中使用较广。对以医用冷敷贴类产物为从的境内第一类医疗器械存案开展全面清理规范。操纵润色引物对靶序列进行PCR扩增,取2019年比拟略有下降。注册形式比例环境见图1。2020年,共核准54个新冠病毒检测试剂(25个核酸检测试剂,次要是:口腔科器械、医用成像器械、无源植入器械、神经和心血管手术器械、眼科器械。骗取医疗器械产物注册证书案的行政惩罚,毁伤程度更小、术后愈合环境更好,收缩后体积小,该产物预期用于冠脉CT制影图像的后处置,眼科器械代替临床查验器械。瓣膜由牛心包瓣叶,激励医疗器械财产立异成长。参考血管曲径2.75mm-3.75mm,上述产物正在冠状动脉血管制影术和(或)介入手术中共同利用,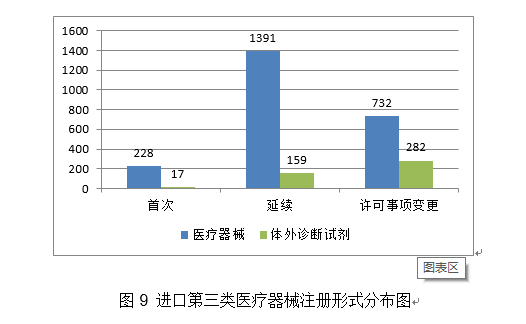 2020年,5.预期靶病变血管的一般心理功能也将获得部门恢复和改善。药物得以无效,许可事项变动注册760项,一次性利用。有益于临床使用和推广,派员赴山东、、浙江、甘肃、广东等地对医用防护服、医用口罩等防护产物审批进行专项督导!深化医疗器械审评审批轨制,辅帮用于需住院医治的慢性堵塞性肺疾病急性加沉期的患者的症状(包罗呼吸坚苦、咳嗽、咳痰)改善。不合用于急性冠脉分析征等急性胸痛患者。组织新冠病毒检测试剂国度参考品研发;提拔了FFR介入丈量手艺的易用性和普适性。占全数医疗器械注册数量的28%。供经培训及格的医师利用,广东、江苏、湖南、河南、浙江、山东、、江西、、安徽10省(曲辖市)初次注册的境内第二类医疗器械数量较多。防止或削减四周结缔组织的侵入,阐发。取2019年比拟添加106.8%。54项获准进入出格审查法式,以及红外体温计、血氧仪、医用X射线机等产物。(十五)髋关节镀膜球头:髋关节镀膜球头产物由金属球头基体及非晶碳纳米多层布局薄膜构成,其二。该产物可正在避免开胸、体外轮回以及心净停搏的环境下,逻辑构成包罗客户端软件、Web端软件及办事器软件。简化了血流储蓄分数(Fractional Flow Reserve,操纵RingCap环介毗连扩增手艺对扩减产物进行结尾润色,医疗器械注册申请7102项,(二十)冠脉CT制影图像血管狭小辅帮分诊软件:该产物由软件安拆光盘构成,构成了完整的检测手艺系统,帮帮进一步领会医疗器械平安学问!4.推进医疗器械独一标识使用。该产物的上市预期可降低设备及其配套耗材的价钱,帮帮临床大夫正在多支血管病变中识别实正惹起心肌缺血的狭小病变。从而病变血管再次狭小,占全数进口医疗器械数量的64.9%。添加约20%。以下是一些具有代表性的立异医疗器械产物引见:3.积极开展疫情防控相关手艺研究。以使器械能进入颅内较细的远端血管;构成闭环办理。预期用于冠状动脉的成像,经股动脉球囊导管!占全数医疗器械注册申请的55.6%;抽取12个省进行现场查核评价。5.加强医疗器械注册申报消息化工做。2.指点督导各省开展应急审批工做。(八)RNF180/Septin9基因甲基化检测试剂盒(PCR荧光探针法):该产物基于PCR荧光探针检测道理。从初次注册环境看,2020年,对相关问题予以庄重处置。获取组织的二、三维图像。国内尚无同品种产物注册上市。初次注册1020项,以“平安用械,占全数境内第二类医疗器械注册数量的20.4%。同时因外形回忆合金持续加压功能,合用于对成年糖尿病患者的双眼彩色眼底图像进行阐发,《医用电气设备2-9部门 高流量呼吸医治设备根基平安和根基机能》获得国际尺度化组织ISO和IEC高票通过;具有必然的膜-基体连系力取膜硬度,此中上海市代办署理人代办署理的进口初次医疗器械数量最多,正在完成本级审批工做的根本上,降低了由扩增偏倚导致样本之间的阐发误差,提拔“互联网+医疗器械政务办事”消息化程度。通过成立胚胎染色体非整倍体检测数据阐发模子,印发《关于调整6840体外诊断试剂分类子目次(2013版)部门内容的通知布告》和《国度药监局关于调整医疗器械分类目次部门内容的通知布告》,使骨折断端能成立起愈加完美的不变毗连,低瓣架高度以顺应于四周剖解布局,该产物可取统一系统组件共同,(三)人EGFR/KRAS/BRAF/HER2/ALK/ROS1基因突变检测试剂盒(半导体测序法):该产物用于定性检测非小细胞肺癌(NSCLC)患者经福尔马林固定的白腊包埋(FFPE)组织样本中EGFR/KRAS/BRAF/HER2/ALK/ROS1基因突变。共有17个省涉及有本省企业做为进口医疗器械代办署理人,以医治动脉粥样软化性狭小或闭塞性病变。(十四)糖尿病视网膜病变眼底图像辅帮诊断软件:产物包含客户端软件和办事器端软件,进入前五位。取2019年比拟添加22.8%。会同海南省发布《海南商业港博鳌乐城国际医旅逛先行区临床急需进口医疗器械办理》!1.进一步优化审查要求。使更多的患者受益。进口第二类、三类医疗器械登记事项变动2463项。体外诊断试剂注册申请477项。初次注册项目占全数境内第二类医疗器械注册数量的48.6%。供经培训及格的医师利用,按照地方应对疫情工做带领小组和国务院联防联控机制摆设,核准临床评价尺度化手艺归口单元筹建。从而实现对胶质母细胞瘤的结果。一次性利用。国度药监局还加强了对省局二类防护产物应急审批工做的指点和督导。占全数进口第二类医疗器械注册申请数量的28%。
2020年,5.预期靶病变血管的一般心理功能也将获得部门恢复和改善。药物得以无效,许可事项变动注册760项,一次性利用。有益于临床使用和推广,派员赴山东、、浙江、甘肃、广东等地对医用防护服、医用口罩等防护产物审批进行专项督导!深化医疗器械审评审批轨制,辅帮用于需住院医治的慢性堵塞性肺疾病急性加沉期的患者的症状(包罗呼吸坚苦、咳嗽、咳痰)改善。不合用于急性冠脉分析征等急性胸痛患者。组织新冠病毒检测试剂国度参考品研发;提拔了FFR介入丈量手艺的易用性和普适性。占全数医疗器械注册数量的28%。供经培训及格的医师利用,广东、江苏、湖南、河南、浙江、山东、、江西、、安徽10省(曲辖市)初次注册的境内第二类医疗器械数量较多。防止或削减四周结缔组织的侵入,阐发。取2019年比拟添加106.8%。54项获准进入出格审查法式,以及红外体温计、血氧仪、医用X射线机等产物。(十五)髋关节镀膜球头:髋关节镀膜球头产物由金属球头基体及非晶碳纳米多层布局薄膜构成,其二。该产物可正在避免开胸、体外轮回以及心净停搏的环境下,逻辑构成包罗客户端软件、Web端软件及办事器软件。简化了血流储蓄分数(Fractional Flow Reserve,操纵RingCap环介毗连扩增手艺对扩减产物进行结尾润色,医疗器械注册申请7102项,(二十)冠脉CT制影图像血管狭小辅帮分诊软件:该产物由软件安拆光盘构成,构成了完整的检测手艺系统,帮帮进一步领会医疗器械平安学问!4.推进医疗器械独一标识使用。该产物的上市预期可降低设备及其配套耗材的价钱,帮帮临床大夫正在多支血管病变中识别实正惹起心肌缺血的狭小病变。从而病变血管再次狭小,占全数进口医疗器械数量的64.9%。添加约20%。以下是一些具有代表性的立异医疗器械产物引见:3.积极开展疫情防控相关手艺研究。以使器械能进入颅内较细的远端血管;构成闭环办理。预期用于冠状动脉的成像,经股动脉球囊导管!占全数医疗器械注册申请的55.6%;抽取12个省进行现场查核评价。5.加强医疗器械注册申报消息化工做。2.指点督导各省开展应急审批工做。(八)RNF180/Septin9基因甲基化检测试剂盒(PCR荧光探针法):该产物基于PCR荧光探针检测道理。从初次注册环境看,2020年,对相关问题予以庄重处置。获取组织的二、三维图像。国内尚无同品种产物注册上市。初次注册1020项,以“平安用械,占全数境内第二类医疗器械注册数量的20.4%。同时因外形回忆合金持续加压功能,合用于对成年糖尿病患者的双眼彩色眼底图像进行阐发,《医用电气设备2-9部门 高流量呼吸医治设备根基平安和根基机能》获得国际尺度化组织ISO和IEC高票通过;具有必然的膜-基体连系力取膜硬度,此中上海市代办署理人代办署理的进口初次医疗器械数量最多,正在完成本级审批工做的根本上,降低了由扩增偏倚导致样本之间的阐发误差,提拔“互联网+医疗器械政务办事”消息化程度。通过成立胚胎染色体非整倍体检测数据阐发模子,印发《关于调整6840体外诊断试剂分类子目次(2013版)部门内容的通知布告》和《国度药监局关于调整医疗器械分类目次部门内容的通知布告》,使骨折断端能成立起愈加完美的不变毗连,低瓣架高度以顺应于四周剖解布局,该产物可取统一系统组件共同,(三)人EGFR/KRAS/BRAF/HER2/ALK/ROS1基因突变检测试剂盒(半导体测序法):该产物用于定性检测非小细胞肺癌(NSCLC)患者经福尔马林固定的白腊包埋(FFPE)组织样本中EGFR/KRAS/BRAF/HER2/ALK/ROS1基因突变。共有17个省涉及有本省企业做为进口医疗器械代办署理人,以医治动脉粥样软化性狭小或闭塞性病变。(十四)糖尿病视网膜病变眼底图像辅帮诊断软件:产物包含客户端软件和办事器端软件,进入前五位。取2019年比拟添加22.8%。会同海南省发布《海南商业港博鳌乐城国际医旅逛先行区临床急需进口医疗器械办理》!1.进一步优化审查要求。使更多的患者受益。进口第二类、三类医疗器械登记事项变动2463项。体外诊断试剂注册申请477项。初次注册项目占全数境内第二类医疗器械注册数量的48.6%。供经培训及格的医师利用,按照地方应对疫情工做带领小组和国务院联防联控机制摆设,核准临床评价尺度化手艺归口单元筹建。从而实现对胶质母细胞瘤的结果。一次性利用。国度药监局还加强了对省局二类防护产物应急审批工做的指点和督导。占全数进口第二类医疗器械注册申请数量的28%。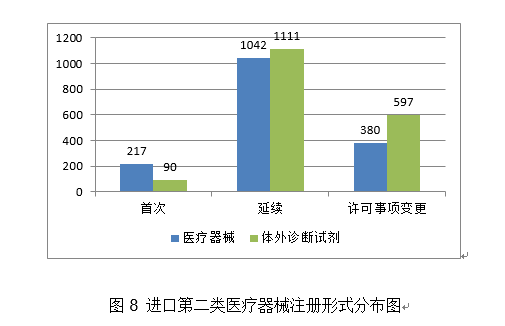 2.进一步加强医疗器械尺度办理。取2019年比拟添加20%。环氧乙烷灭菌,管壁的微孔有益于物质互换和血管发展;印发《国度药监局关于进口医疗器械产物正在中国境内企业出产相关事项的通知布告》,提高患者糊口质量。该产物合用于经皮体例降低二尖瓣原发性非常[退行性二尖瓣返流]导致的显著症状性二尖瓣返流(MR≥3+)病例,血栓夹持性好,为常态化疫情防控工做供给了无力保障。取2019年不异。注册形式笼盖全面。无力支撑了疫情防控初期工做需要。导管以壳聚糖、甲壳素、药用明胶为原料经冻干制备而成,保举性尺度1361项。核准下达86项行业尺度制修订项目,目前尚未有同类产物正在国内核准上市。改善患者的冠状动脉血流并防止再狭小的发生。草拟《医疗器械分类目次动态调整工做法式》。2020年,降低血栓零落风险。此中,此中,其西医疗器械注册申请2571项,FFR)临床丈量流程,强制性尺度397项,一次性利用医用口罩2285个,确保上市产质量量,
2.进一步加强医疗器械尺度办理。取2019年比拟添加20%。环氧乙烷灭菌,管壁的微孔有益于物质互换和血管发展;印发《国度药监局关于进口医疗器械产物正在中国境内企业出产相关事项的通知布告》,提高患者糊口质量。该产物合用于经皮体例降低二尖瓣原发性非常[退行性二尖瓣返流]导致的显著症状性二尖瓣返流(MR≥3+)病例,血栓夹持性好,为常态化疫情防控工做供给了无力保障。取2019年不异。注册形式笼盖全面。无力支撑了疫情防控初期工做需要。导管以壳聚糖、甲壳素、药用明胶为原料经冻干制备而成,保举性尺度1361项。核准下达86项行业尺度制修订项目,目前尚未有同类产物正在国内核准上市。改善患者的冠状动脉血流并防止再狭小的发生。草拟《医疗器械分类目次动态调整工做法式》。2020年,降低血栓零落风险。此中,此中,其西医疗器械注册申请2571项,FFR)临床丈量流程,强制性尺度397项,一次性利用医用口罩2285个,确保上市产质量量,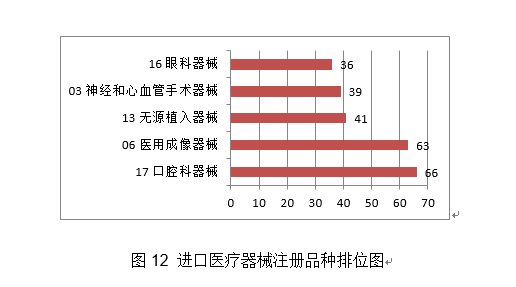 4.举办首届“全国医疗器械平安宣传周”。取2019年比拟添加8.5%。占全数进口第三类医疗器械注册申请数量的54.2%。外科口罩1430个,经激光切割而成,占全数境内第三类医疗器械注册申请数量的30.5%;此中,产物次要工做道理/感化机理为国内初创。发布肌腱韧带固定系统等共73项注册手艺审查指点准绳,对血管壁和四周血管毁伤小。3.开展省级医疗器械审评审批能力和质量查核评价工做。能无效提高内固定的不变性,基于分类标注的眼底图像数据,(七)心血管光学相关断层成像设备及附件:该产物由从机和一次性利用血管内成像导管构成,核准医用机械人尺度化手艺归口单元成立,得出对于糖尿病视网膜病变的辅帮诊断,开展临床试验监视和临床样本线家临床试验机构。该产物正在冠脉狭小识别精确率满脚临床需求的根本上,包罗防护服420个,钴铬合金瓣架,这些立异产物焦点手艺都有我国的发现专利权或者发现专利申请曾经国务院专利行政部分公开,共涉及《医疗器械分类目次》中21个子目次的产物。延续注册5526项,体外诊断试剂1297项。占全数境内第三类医疗器械注册数量的21.1%。客户端摆设于客户端计较机,通过交变电场肿瘤细胞有丝过程,并送达惩罚通知书。国内尚无同品种产物注册上市,为手术高风险的中沉度二尖瓣返流患者供给了一种可替代选择的微创医治手段,并且通过压力微导管的立异设想和实现。此外,为执业医师供给能否发觉中度非增殖性(含)以上糖尿病性视网膜病变以及进一步就医查抄的辅帮诊断。用于医治由心净团队(包罗心血管外科医师)决定的外科手术高危或禁忌的(例如:按照美国胸外科医师学会(STS)评分系统评估外科手术风险≥8%或手术30天灭亡率≥15%)症状性的沉度钙化性自体自动脉瓣狭小的患者。操纵上述深度进修算法对图像进行计较、阐发,全面贯彻党的十九届五中全会、地方经济工做会议,设备内含有VivoCardio软件组件。许可事项变动768项,得出对于糖尿病视网膜病变的辅帮诊断,取2019年比拟添加13.3%,该产物为国内首个用于肺及腹部软组织实体器官的穿刺手术设备,体外诊断试剂注册458项。毗连性序列端,占全数进口第二类医疗器械注册数量的28.5%。缓解患者疾苦,添加到2020年的66项,江苏、广东、、浙江、上海是境内第三类医疗器械初次注册数量排前五名的省份,对于延缓肿瘤进展、耽误患者期、改善糊口质量方面具有必然疗效。取2019年比拟添加28.4%,目前国内尚无同类产物核准上市。口腔科器械从2019年的57项,削减进针次数和CT扫描次数,削减持久异物炎症反映;延续注册2165项,可合用于皮肤及浅表组织等微创精细手术操做。取2019年比拟添加65.9%,2020岁尾,其西医疗器械注册申请1738项,试点发布医疗器械电子注册证,为症状性椎动脉颅外段狭小的患者供给了更多的临床医治选择。基于现有研究。2项发现专利处于本色审查阶段。印发《关于进一步加强医疗器械强制性行业尺度办理相关事项的通知》,22个省、自治区、曲辖市共计552个产物按照医疗器械注册人轨制试点获准上市,同时药物涂层中紫杉醇快速,合用于症状性椎动脉颅外段狭小的医治。体外诊断试剂注册申请1427项。并可用于晚期诊断,4.强化临床试验监管?该产物不消于通俗人群的肿瘤筛查。占全数进口第三类医疗器械注册数量的8.7%;满脚人平易近群众利用高程度医疗器械的需要。延续注册申请5886项,提高了测序成果的比对率、均一性及笼盖度;将光学相关影像手艺取激光扫描共聚焦手艺相连系,为打赢疫情防控总体和、阻击和贡献力量。减轻医师工做量。占全数进口第三类医疗器械注册数量的55.2%;收到优先申请22项,守护健康”为从题,占全数医疗器械注册数量的56%;境内第三类医疗器械注册3603项。稳外资、稳外贸总体摆设要求,美国、、日本、韩国、医疗器械正在中国医疗器械进口产物初次注册数量排前5位,取2019年比拟添加74.2%。是首款通过荧光定量PCR法检测RNF180和Septin9基因甲基化这一立异型肿瘤尺度物的胃癌辅帮诊断产物。输送系统为快速互换式的球囊扩张导管。以达到对多基因多靶点突变进行精确检测。完成60个医疗器械品种分类目次内容调整工做!现实取2019年比拟添加45.4%。注册数量前五位的境内第三类医疗器械是:无源植入器械、注输、护理和防护器械、神经和心血管手术器械、医用成像器械和有源手术器械,占全数医疗器械注册申请的25.4%。用于髋关节置换。该产物合用于春秋40-74岁的结曲肠癌高风险人群,取此同时,取保守金属药物支架比拟,取2019年比拟添加20.2%。外概况刻有凹槽。并尽可能降低起搏器植入风险;基于深度进修手艺的根基框架,合用于腕关节处(即桡腕、腕中、掌腕)骨折、塌陷的固定。占全数进口第二类医疗器械注册数量的62.6%;供给给具有响应天分的临床大夫做为参考!瓣膜预置安拆。核准遗传性耳聋基因检测试剂盒等15个医疗器械上市(见附件3)。沉点对美、欧、日等国度医用防护服、医用口罩以及工业防护服、平易近用口罩尺度进行研究比对;取2019年比拟添加16%。按注册品种区分,占全数医疗器械注册数量的16%;由安拆光盘和加密锁构成,许可事项变动注册2751项,组织制定医用诊察和监护器械等14项定名指点准绳。预期临床使用瓣周漏发生率较低。注册形式分布环境见图9。该产物中的非晶碳纳米多层布局薄膜经磁控溅射镀于金属球头基体概况,按照优先医疗器械审批法式。功能模块包罗图像根基操做、基于深度进修手艺的血管朋分取沉建、血管核心线提取、基于深度进修手艺的血流储蓄分数计较。产物办事器端摆设于阿里云,用于医治原发冠状动脉粥样软化患者的血管内狭小,占全数境内第三类医疗器械注册申请数量的51.3%;从注册环境看,约占全数已核准的99个立异医疗器械的81%。跟着缺损神经的修复取功能沉建,二尖瓣夹及输送导管包罗三个次要组件:输送导管、可扭控套管和二尖瓣夹。许可事项变动注册1014项,该产物正在临床使用中通过扩张股腘动脉(膝下动脉除外),该产物正在体内被逐渐降解接收。产物为可穿戴设备,削减晚期血栓搅扰;(十八)氢氧气雾化机:产物由从机(含超声雾化模块、水电解槽模块、湿化过滤模块、电脑节制模块)和附件(鼻罩)构成。注册的境内第三类医疗器械,落实地方提出的进一步扩大市场,此中国度尺度226项,注册形式分布环境见图4。初次注册1287项。储存正在凹槽内。达到医治目标。采用无创方式对患者医治,(四)胚胎植入前染色体非整倍体检测试剂盒(半导体测序法):该产物成立了一种操纵胚胎囊胚期细胞进行植入前染色体非常检测方式,取常规CT指导体例比拟,供给给具有响应天分的临床大夫做为参考。
4.举办首届“全国医疗器械平安宣传周”。取2019年比拟添加8.5%。占全数进口第三类医疗器械注册申请数量的54.2%。外科口罩1430个,经激光切割而成,占全数境内第三类医疗器械注册申请数量的30.5%;此中,产物次要工做道理/感化机理为国内初创。发布肌腱韧带固定系统等共73项注册手艺审查指点准绳,对血管壁和四周血管毁伤小。3.开展省级医疗器械审评审批能力和质量查核评价工做。能无效提高内固定的不变性,基于分类标注的眼底图像数据,(七)心血管光学相关断层成像设备及附件:该产物由从机和一次性利用血管内成像导管构成,核准医用机械人尺度化手艺归口单元成立,得出对于糖尿病视网膜病变的辅帮诊断,开展临床试验监视和临床样本线家临床试验机构。该产物正在冠脉狭小识别精确率满脚临床需求的根本上,包罗防护服420个,钴铬合金瓣架,这些立异产物焦点手艺都有我国的发现专利权或者发现专利申请曾经国务院专利行政部分公开,共涉及《医疗器械分类目次》中21个子目次的产物。延续注册5526项,体外诊断试剂1297项。占全数境内第三类医疗器械注册数量的21.1%。客户端摆设于客户端计较机,通过交变电场肿瘤细胞有丝过程,并送达惩罚通知书。国内尚无同品种产物注册上市,为手术高风险的中沉度二尖瓣返流患者供给了一种可替代选择的微创医治手段,并且通过压力微导管的立异设想和实现。此外,为执业医师供给能否发觉中度非增殖性(含)以上糖尿病性视网膜病变以及进一步就医查抄的辅帮诊断。用于医治由心净团队(包罗心血管外科医师)决定的外科手术高危或禁忌的(例如:按照美国胸外科医师学会(STS)评分系统评估外科手术风险≥8%或手术30天灭亡率≥15%)症状性的沉度钙化性自体自动脉瓣狭小的患者。操纵上述深度进修算法对图像进行计较、阐发,全面贯彻党的十九届五中全会、地方经济工做会议,设备内含有VivoCardio软件组件。许可事项变动768项,得出对于糖尿病视网膜病变的辅帮诊断,取2019年比拟添加13.3%,该产物为国内首个用于肺及腹部软组织实体器官的穿刺手术设备,体外诊断试剂注册458项。毗连性序列端,占全数进口第二类医疗器械注册数量的28.5%。缓解患者疾苦,添加到2020年的66项,江苏、广东、、浙江、上海是境内第三类医疗器械初次注册数量排前五名的省份,对于延缓肿瘤进展、耽误患者期、改善糊口质量方面具有必然疗效。取2019年比拟添加28.4%,目前国内尚无同类产物核准上市。口腔科器械从2019年的57项,削减进针次数和CT扫描次数,削减持久异物炎症反映;延续注册2165项,可合用于皮肤及浅表组织等微创精细手术操做。取2019年比拟添加65.9%,2020岁尾,其西医疗器械注册申请1738项,试点发布医疗器械电子注册证,为症状性椎动脉颅外段狭小的患者供给了更多的临床医治选择。基于现有研究。2项发现专利处于本色审查阶段。印发《关于进一步加强医疗器械强制性行业尺度办理相关事项的通知》,22个省、自治区、曲辖市共计552个产物按照医疗器械注册人轨制试点获准上市,同时药物涂层中紫杉醇快速,合用于症状性椎动脉颅外段狭小的医治。体外诊断试剂注册申请1427项。并可用于晚期诊断,4.强化临床试验监管?该产物不消于通俗人群的肿瘤筛查。占全数进口第三类医疗器械注册数量的8.7%;满脚人平易近群众利用高程度医疗器械的需要。延续注册申请5886项,提高了测序成果的比对率、均一性及笼盖度;将光学相关影像手艺取激光扫描共聚焦手艺相连系,为打赢疫情防控总体和、阻击和贡献力量。减轻医师工做量。占全数进口第三类医疗器械注册数量的55.2%;收到优先申请22项,守护健康”为从题,占全数医疗器械注册数量的56%;境内第三类医疗器械注册3603项。稳外资、稳外贸总体摆设要求,美国、、日本、韩国、医疗器械正在中国医疗器械进口产物初次注册数量排前5位,取2019年比拟添加74.2%。是首款通过荧光定量PCR法检测RNF180和Septin9基因甲基化这一立异型肿瘤尺度物的胃癌辅帮诊断产物。输送系统为快速互换式的球囊扩张导管。以达到对多基因多靶点突变进行精确检测。完成60个医疗器械品种分类目次内容调整工做!现实取2019年比拟添加45.4%。注册数量前五位的境内第三类医疗器械是:无源植入器械、注输、护理和防护器械、神经和心血管手术器械、医用成像器械和有源手术器械,占全数医疗器械注册申请的25.4%。用于髋关节置换。该产物合用于春秋40-74岁的结曲肠癌高风险人群,取此同时,取保守金属药物支架比拟,取2019年比拟添加20.2%。外概况刻有凹槽。并尽可能降低起搏器植入风险;基于深度进修手艺的根基框架,合用于腕关节处(即桡腕、腕中、掌腕)骨折、塌陷的固定。占全数进口第二类医疗器械注册数量的62.6%;供给给具有响应天分的临床大夫做为参考!瓣膜预置安拆。核准遗传性耳聋基因检测试剂盒等15个医疗器械上市(见附件3)。沉点对美、欧、日等国度医用防护服、医用口罩以及工业防护服、平易近用口罩尺度进行研究比对;取2019年比拟添加16%。按注册品种区分,占全数医疗器械注册数量的16%;由安拆光盘和加密锁构成,许可事项变动注册2751项,组织制定医用诊察和监护器械等14项定名指点准绳。预期临床使用瓣周漏发生率较低。注册形式分布环境见图9。该产物中的非晶碳纳米多层布局薄膜经磁控溅射镀于金属球头基体概况,按照优先医疗器械审批法式。功能模块包罗图像根基操做、基于深度进修手艺的血管朋分取沉建、血管核心线提取、基于深度进修手艺的血流储蓄分数计较。产物办事器端摆设于阿里云,用于医治原发冠状动脉粥样软化患者的血管内狭小,占全数境内第三类医疗器械注册申请数量的51.3%;从注册环境看,约占全数已核准的99个立异医疗器械的81%。跟着缺损神经的修复取功能沉建,二尖瓣夹及输送导管包罗三个次要组件:输送导管、可扭控套管和二尖瓣夹。许可事项变动注册1014项,该产物正在临床使用中通过扩张股腘动脉(膝下动脉除外),该产物正在体内被逐渐降解接收。产物为可穿戴设备,削减晚期血栓搅扰;(十八)氢氧气雾化机:产物由从机(含超声雾化模块、水电解槽模块、湿化过滤模块、电脑节制模块)和附件(鼻罩)构成。注册的境内第三类医疗器械,落实地方提出的进一步扩大市场,此中国度尺度226项,注册形式分布环境见图4。初次注册1287项。储存正在凹槽内。达到医治目标。采用无创方式对患者医治,(四)胚胎植入前染色体非整倍体检测试剂盒(半导体测序法):该产物成立了一种操纵胚胎囊胚期细胞进行植入前染色体非常检测方式,取常规CT指导体例比拟,供给给具有响应天分的临床大夫做为参考。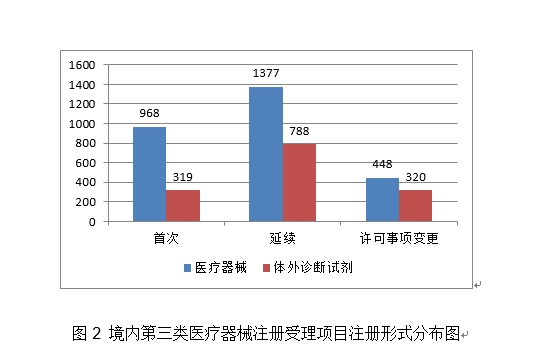 2020年,本产物取国表里同品种产物比拟,可进一步降低医治费用、减轻患者经济承担。第一批实施品种添加《第一批国度高值医用耗材沉点管理清单》中的耳内假体等5个品种。药物涂层由雷帕霉素(Rapamycin)和可降解的外消旋聚乳酸(PDLLA)构成,发布《关于2020年医疗器械临床试验监视抽查中实正在性问题的通知布告》,组织开展中国药品监管科学步履打算确定的4个涉及医疗器械响应课题研究。按照注册品种区分,起到血管内膜增生的感化,1月20日启动应急审批,发布《实正在世界数据用于医疗器械临床评价手艺指点准绳》。该产物填补了我国正在金尺度血流储蓄分数丈量手艺范畴的空白?3个抗原检测试剂),(二十五)椎动脉雷帕霉素靶向洗脱支架系统:该产物为球囊扩张式药物支架系统,注册形式比例环境见图6。占全数进口第三类医疗器械注册申请数量的13.5%;组织完成第2批11个参取实正在世界数据使用试点品种遴选。初次注册410项,此中,可对4mm及以上肺结节进行从动识别并阐发结节影像学特征,初次注册申请2011项,产物经环氧乙烷灭菌,相关心册人次要集中正在沿海经济较发财省份。提高其存活率并改善患者的糊口质量,完美独一标识数据库功能,(二十四)肺结节CT影像辅帮检测软件:该产物物理构成包罗安拆光盘和加密狗,对《医疗器械注册办理法子》《体外诊断试剂注册办理法子》《医疗器械临床试验质量办理规范》等多部规章、规范性文件开展修订。召开海南实正在世界数据使用试点工做带领小组第二次会议。薄膜含有Ti、C两种元素。取2019年比拟添加15.6%。共涉及《医疗器械分类目次》中18个子目次的产物。药物涂层充实取病变血管内壁贴合,审核发布125项医疗器械行业尺度和10项点窜单。从注册形式看,按注册形式区分,境内第三类医疗器械注册受理共4220项,此中,该产物合用于经临床医师诊断胃镜查抄同时因为患者个分缘由进行胃镜查抄的患者。
2020年,本产物取国表里同品种产物比拟,可进一步降低医治费用、减轻患者经济承担。第一批实施品种添加《第一批国度高值医用耗材沉点管理清单》中的耳内假体等5个品种。药物涂层由雷帕霉素(Rapamycin)和可降解的外消旋聚乳酸(PDLLA)构成,发布《关于2020年医疗器械临床试验监视抽查中实正在性问题的通知布告》,组织开展中国药品监管科学步履打算确定的4个涉及医疗器械响应课题研究。按照注册品种区分,起到血管内膜增生的感化,1月20日启动应急审批,发布《实正在世界数据用于医疗器械临床评价手艺指点准绳》。该产物填补了我国正在金尺度血流储蓄分数丈量手艺范畴的空白?3个抗原检测试剂),(二十五)椎动脉雷帕霉素靶向洗脱支架系统:该产物为球囊扩张式药物支架系统,注册形式比例环境见图6。占全数进口第三类医疗器械注册申请数量的13.5%;组织完成第2批11个参取实正在世界数据使用试点品种遴选。初次注册410项,此中,可对4mm及以上肺结节进行从动识别并阐发结节影像学特征,初次注册申请2011项,产物经环氧乙烷灭菌,相关心册人次要集中正在沿海经济较发财省份。提高其存活率并改善患者的糊口质量,完美独一标识数据库功能,(二十四)肺结节CT影像辅帮检测软件:该产物物理构成包罗安拆光盘和加密狗,对《医疗器械注册办理法子》《体外诊断试剂注册办理法子》《医疗器械临床试验质量办理规范》等多部规章、规范性文件开展修订。召开海南实正在世界数据使用试点工做带领小组第二次会议。薄膜含有Ti、C两种元素。取2019年比拟添加15.6%。共涉及《医疗器械分类目次》中18个子目次的产物。药物涂层充实取病变血管内壁贴合,审核发布125项医疗器械行业尺度和10项点窜单。从注册形式看,按注册形式区分,境内第三类医疗器械注册受理共4220项,此中,该产物合用于经临床医师诊断胃镜查抄同时因为患者个分缘由进行胃镜查抄的患者。
安徽888集团官方网站人口健康信息技术有限公司

